Ya hace tiempo escribí sobre pegas que se le ponen a la vitamina C:
que si el ácido ascorbico no es la vitamina C natural, que si es abortiva,
que si es oxidante y cancerígena. Esta vez voy a comentar sobre quizás la pega más extendida al consumo de vitamina C: su potencial papel en la ocurrencia de piedras en el riñón (cálculos renales) de oxalato cálcico. Para ver cómo de grave y cómo de probable es este peligro, vamos a ver este tema en profundidad:
El ácido oxálico es una sustancia producto, principalmente, del metabolismo de glúcidos en plantas.
Los mamíferos no metabolizamos el ácido oxálico y por tanto es una sustancia de desecho para nosotros; eso sí, nuestra flora intestinal puede contener bacterias que sí lo procesan, como la
Oxalobacter formigenes (aunque no está clara la utilidad de suplementar probióticos
dada su deficiente calidad). Se puede conseguir una menor absorción además de mediante su degradación por bacterias en nuestro intestino, simplemente por su precipitación al reaccionar con el calcio durante la digestión: igual que el oxalato cálcico puede formar piedras en el riñón por su baja solubilidad, también la reacción del ácido oxálico con el calcio sirve para impedir su absorción en el intestino; dado que además parece que la solubilidad del oxalato cálcico
aumenta según se acidifica el medio, será en principio baja en las
condiciones típicamente tirando a alcalinas del intestino.
Además de su ingestión, también tenemos cierta producción endógena, bien a partir del metabolismo de la hidroxiprolina, bien del del ácido ascórbico, bien de algún otro sospechoso (fructosa, glicina, serina), tal y como exponen en su completo trabajo
Glew et alter* (2014); los edulcorantes
xilitol y sorbitol también son sospechosos.
Así en el estudio de
Knight et alter* (2006) constataron cómo ante la ingesta de 10g de gelatina,
rica en los aminoácidos hidroxiprolina y glicina, se produjo un incremento del 43% en la excreción de oxalato en la orina en individuos sanos. Si bien es poco trascendente en el caso de personas normales sin consumo excesivo de colágeno, en algunos desórdenes genéticos que dan lugar a hiperoxaluria (excreción excesiva de ácido oxálico en la orina) puede ser la causa principal de esta, tal y como comentan
Fargue et alter* (2018).
La ingestión oral de vitamina C o su infusión intravenosa también trae consigo un aumento de la excreción de oxalatos en la orina, tanto en individuos sanos como en propensos a generar cálculos renales. Así
Calábria et alter* (2003) constatan un aumento de un 56% en la excreción diaria de oxalatos en individuos sanos tras la ingestión de 1g de vitamina C dividido en dos dosis, algo mayor, 61%, en propensos a generar piedras en el riñón.
Robitaille et alter* (2009) corroboraron el aumento de excreción de oxalatos en orina en función de dosis crecientes de vitamina C intravenosa, estimando una conversión del 0'5% de la dosis de vitamina C en oxalatos.
¿Cuáles son las potenciales consecuencias de un exceso de concentración de ácido oxálico en la orina? Pues bien, está la
suave, los cálculos renales de oxalato cálcico, y la
severa, la nefropatía por oxalatos.
Los cálculos renales pueden ser de
varios tipos, siendo el más común el de cristales de oxalato cálcico.
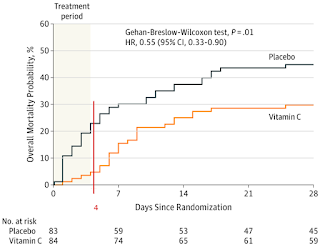
Prier et alter* (2018) presentan un estudio prospectivo con los 157 pacientes recibiendo vitamina C intravenosa en su clínica desde septiembre de 2011 hasta agosto del 2012 con seguimiento de 12 meses de cada paciente, contactado telefónicamente o revisada la causa de defunción en el 94% de los 157: de los 6 sin información a los 12 meses, 4 se habían mudado a ultramar, 1 había fallecido y no había información sobre posibles cálculos renales, y el último no pudo ser localizado. Habiendo recibido los pacientes un promedio de 15 tratamientos (rango de 1 a 119) con dosis promedio de 50g de vitamina C (rango de 15 a 125), ningún cálculo renal fue notificado incluso en aquellos con historia previa de ellos, el 8% de los pacientes. También comentan sobre hallazgos epidemiológicos previos:
- Simon & Hudes (1999) en un estudio transversal con unos 10.735 individuos no encuentran relación estadísticamente significativa entre nivel sérico de vitamina C e incidencia de piedras en el riñón ni en mujeres ni en varones, con indicio de relación inversa —mayor nivel de vitamina C en sangre, menos probabilidad de cálculos renales— en estos con razón de probabilidades de 0'72 (P=0'06) por cada incremento de 1mg/dl de concentración de vitamina C.
- Curhan et alter* (1996) realizan un estudio prospectivo sobre 45.251 varones con seguimiento de 6 años, no encuentran relación estadísticamente significativa entre consumo de vitamina C e incidencia de cálculos renales, con indicio de relación inversa con riesgo relativo de 0'78 (intervalo de confianza del 95% de 0'54 a 1'11) entre consumir 1'5g diarios o más frente a 0'25 o menos.
- Curhan et alter* (1999) realizan un estudio prospectivo sobre 85.557 mujeres con seguimiento de 14 años, no encuentran relación entre consumo de vitamina C e incidencia de cálculos renales.
- Ferraro et alter* (2016) realizan un estudio prospectivo sobre 156.735 mujeres y 40.536 varones con seguimiento de unos 11 años, no encuentran relación estadísticamente significativa entre consumo de vitamina C y cálculos renales para las mujeres en el modelo con ajuste multivariable pero sí para los hombres, con un cociente de riesgos de 1'43 (intervalo de confianza del 95% de 1'15 a 1'79) para un consumo mayor a 1g diario frente a uno menor a 0'09g al día en su modelo con ajuste multivariable... de 14 variables; en modelo ajustado sólo por edad, el cociente de riesgos es de 0'98 (intervalo de confianza del 95% de 0'90 a 1'09); en el modelo ajustado sólo por edad para mujeres, el cociente de riesgos entre ambos consumos es de 0'76 (intervalo de confianza del 95% de 0'69 a 0'82).
- Thomas et alter* (2013) realizan un estudio prospectivo sobre 23.355 varones con seguimiento de 11 años, encuentran relación estadísticamente significativa entre consumo de vitamina C y cálculos renales, con un cociente de riesgos de 1'90 (intervalo de confianza del 95% de 1'32 a 2'73) para los consumidores de suplementos de vitamina C frente a los que no en el modelo ajustado por edad. En este estudio excluyeron aquellos que suplementaban otras cosas además de vitamina C, y la incidencia extra de individuos con cálculos renales por suplementar vitamina C era del 0'0147% anual.
- Taylor et alter* (2004) realizan un estudio prospectivo sobre 45.619 varones con seguimiento de 14 años (continuación de Curhan et alter* 1996), encuentran relación estadísticamente significativa entre consumo de vitamina C y cálculos renales con un cociente de riesgos de 1'41 (intervalo de confianza del 95% de 1'11 a 1'80) para un consumo mayor a 1g diario frente a uno menor a 0'09g al día en su modelo con ajuste multivariable... de 11 variables; en modelo ajustado sólo por edad, el cociente de riesgos entre ambos consumos es de 1'01 (intervalo de confianza del 95% de 0'81 a 1'22).
¿Qué nos muestra la epidemiología?
Lo primero, que los procesadores de encuestas de Harvard (todos los autores o parte de Curhan
et alter* 1996 y 1999, Ferraro
et alter* 2016 y Taylor
et alter* 2004) fueron finalmente capaces de arrancar la confesión a los datos. No es algo nuevo, pues ya están acostumbrados los procesadores de encuestas a ajustar lo que
haga falta hasta que el resultado se mueva a su gusto, con otro ejemplo
claro el comentado por
Paul Jaminet en su blog al respecto de los suplementos de vitaminas y minerales, que incluye la esclarecedora cita de Von Neumann:
Con cuatro parámetros puedo ajustar un elefante, y con cinco puedo hacer que mueva su trompa.
Lo segundo, que, de ser real, el riesgo es bajo y quizás se anula con suplementación de algo más, visto el estudio de Thomas
et alter* (2013) y las variables de los modelos confesantes de Harvard.
También sobre tratamiento de vitamina C intravenosa, tenemos el retrospectivo de
Bazzan et alter* (2018) sobre 86 pacientes de cáncer durante 7 años en el hospital universitario Thomas Jefferson, recibiendo un total de 3.034 tratamientos con dosis en el rango de 50 a 150g; todos habían sido evaluados para una correcta función renal antes del (y durante el) tratamiento y también habían sido excluidos del mismo aquellos con historia de cálculos renales. Los efectos adversos renales fueron:
- Un paciente con empeoramiento de función renal, achacado a infecciones recurrentes y al linfoma en progresión, resultando en obstrucción.
- Otro paciente con empeoramiento de función renal, acudió al hospital tras episodio de náuseas y vómitos, recuperó función normal tras dos días de hidratación intravenosa.
- Un tercer paciente sufrió un cálculo renal, sin decremento de la función renal.
A pesar de ya haber habido numerosos ensayos aleatorizados con consumo diario de dosis de gramos de vitamina C, parece no haber surgido ningún indicio de mayor riesgo de cálculos renales por la suplementación de la misma, aunque
el capítulo de libro de 1997 (octava referencia de
Pullar et alter* 2013) donde se cita tal resultado no lo tengo accesible.
La nefropatía por oxalatos es una lesión rara pero grave que trae consigo daño renal y en casos extremos puede dar lugar a
enfermedad renal en etapa final, es decir, fallo renal irreversible y necesidad de, bien tratamiento crónico de diálisis, bien trasplante. La diferencia con los cálculos renales está en la precipitación más en el inicio de trayecto de los cristales de oxalato, dañando estructuras delicadas del riñón.
Las causas pueden ser variadas. Así en el estudio de
Getting et alter* (2013) citan como causas en su primera tabla:
- Con hiperoxaluria (exceso de oxalatos en la orina):
- ingestión de:
- alimentos ricos en oxalatos,
- vitamina C,
- etilenglicol (anticongelante de coches);
- aumento de absorción intestinal,
- hiperoxaluria primaria (endogénesis aumentada por causa genética),
- hiperoxaluria tras trasplante de riñón;
- insuficiencia renal derivando en oxalosis (deposición de cristales de oxalato) sistémica (internamente en todo el cuerpo) y renal.
Decir que el aumento de absorción intestinal va ligado usualmente a la mala absorción de grasas, cuyos ácidos grasos terminan ligando al calcio y dejando la vía libre a la absorción intestinal del ácido oxálico. Esta situación puede producirse, por ejemplo,
tras cirugía bariátrica o con medicamentos (sin sentido) que impidan la absorción de grasas como el
Orlistat; no está claro si es factor causal próximo en
el caso de pancreatitis crónica.
Getting
et alter* revisaron los casos diagnosticados en la Clínica Mayo entre 1985 y 2010, 65 biopsias de riñón con cristales de oxalato de un total de 7.378 realizadas, e identificaron la causa de todas ellas, con 29 casos con dos o más causas concurrentes. En tres casos una de las causas identificadas fue la dieta (e insuficiencia renal):
- El caso que dio lugar al artículo. Varón de 81 años consumiendo batidos verdes (también implicados en el caso de mujer de 65 años tras cirugía bariátrica) en todas sus comidas con intención de adelgazar (previamente venía suplementando 2g de vitamina C al día durante al menos los 3 años previos), incluyendo alimentos ricos en oxalatos, con un consumo medio estimado de 1'26g al día (en dieta usual sería en torno a 0'1–0'15g al día); tenía enfermedad renal estable; tras fallo renal agudo y confirmación de nefropatía por oxalatos mediante biopsia, se le practicaron varias diálisis en los 10 días de estancia en el hospital y fue puesto a dieta baja en oxalatos; a los 4 meses había recuperado casi la totalidad de la función renal inicial.
- Varón de 71 años con diabetes y enfermedad renal crónica, con consumo de dieta alta en oxalatos y suplementando una cantidad indefinida de vitamina C e histórico de cálculos renales.
- Varón de 75 años con enfermedad renal crónica estable y dieta alta en oxalatos (básicamente cacahuetes).
También en su segunda tabla identifican otros casos donde uno de los factores fue la ingestión de vitamina C:
- dos casos tras trasplante de riñón, uno de ellos con absorción de oxalatos aumentada,
- otro caso más con factor insuficiencia renal (como los desglosados más arriba).
En resumen, en este muestreo de 7.378 pacientes con biopsia de riñón, 65 de ellos tenían nefropatía por oxalatos, de los cuales en 5 casos estaba implicado el consumo de vitamina C a mayores de, al menos, bien insuficiencia renal, bien trasplante de riñón.
Además de los de la Clínica Mayo, ¿tenemos constancia de más casos de nefropatía por oxalatos en la literatura científica donde esté implicada la vitamina C?
Knight et alter* (2017) repasan la literatura científica identificando 10 casos en su
segunda tabla:
- Varón de 73 años con dieta alta en oxalatos, diarrea crónica (¿mala absorción de grasas?), bajo furosemida (diurético con posible ligerísimo efecto de reducción de expulsión de oxalatos en orina) y suplementando 0'68g al día de vitamina C; tras seis hemodiálisis y tres meses sin suplemento de vitamina C, con dieta baja en oxalatos y con suplemento de 100mg al día de vitamina B6, recuperó la función renal normal.
- Varón de 61 años con cáncer de próstata e insuficiencia renal, suplementando jugo verde incluyendo ruibarbo (muy alto en oxalatos) durante tres semanas, sufre fallo renal agudo dos días después de una infusión intravenosa de 60g de vitamina C; recupera parte de la función renal tras 43 días hospitalizado.
- Mujer de 51 años con lupus y anemia, insuficiencia renal aguda tras dos infusiones intravenosas de vitamina C en cantidad indeterminada y con anemia agravada (¿efecto de oxalatos?); recuperada la función renal casi totalmente tras tiempo indeterminado.
- Mujer de 58 años con amiloidosis y consecuente síndrome nefrótico (daño renal), es diagnosticada con fallo renal agudo tras administración de 45g de vitamina C intravenosa; fallece al quinto día de hospitalización tras fibrilación ventricular intratable; en la autopsia se comprueban placas amiloides en arterias coronarias y signos de infarto de miocardio agudo, sin cristales de oxalatos fuera de los riñones.
- Varón de 58 años hospitalizado por quemaduras de tercer grado en el 40% de su cuerpo y daño renal, recibió, entre otros tratamientos, 1g de vitamina C al día por vía intravenosa; tras dos meses, aún hospitalizado, una biopsia del riñón mostró nefropatía por oxalatos, por lo que se le redujo la dosis de vitamina C a 0'2g al día y se le pautó un régimen agresivo de diálisis durante dos semanas; pasado el tiempo recuperó la función renal, murió de un ataque al corazón al cabo de un año y en la autopsia ya no aparecieron depósitos de oxalato cálcico en ningún tejido.
- Varón de 31 años consumidor de 2–2'5g diarios de vitamina C, es ingresado con fallo renal tras varios días de un consumo de 5g diarios de vitamina C, 6 días de dolor de cabeza y 3 de náuseas y vómitos; recupera función renal tras tratamiento de diálisis y suspensión de suplementación.
- Mujer de 49 años consumidora de 4g diarios de vitamina C por varios meses y altas dosis de ibuprofeno por migrañas, sufre de insuficiencia renal tras 24 horas de náuseas y vómitos; se le practicaron 4 sesiones de diálisis y recuperó de manera paulatina la función renal; los autores achacan parte del daño renal a la situación de deshidratación debida a las náuseas y vómitos.
- Varón de 72 años (Lamarche et alter* 2011) con enfermedad pulmonar oclusiva crónica, con dieta el último año alta en oxalatos y con consumo de bebida con vitamina C dando lugar a una ingestión de unos 0'48–0'96g diarios, es llevado a urgencias donde le diagnostican nefropatía por oxalatos tras inicio de tratamiento de diálisis; el paciente recupera la función renal tras parar las suplementación.
- Varón de 72 años consumidor habitual de varios gramos de vitamina C diarios y con hemicolestomia (mitad del colon extirpado), acude al hospital con insuficiencia renal y deshidratado (¿propenso debido a colestomía parcial?), pero declina taxativamente medidas de resucitación incluyendo hemodiálisis; fallece al cabo de unos días y el diagnóstico de nefropatía por oxalatos es establecido en la autopsia.
- Mujer de 58 años (el artículo enlazado hace un repaso también de la incidencia general de la nefropatía por oxalatos) celiaca con un consumo de unos 3–6'5g diarios de vitamina C el último mes, acude al médico tras 5 semanas de debilidad, apetito reducido y halitosis, se le diagnostica fallo renal agudo (3 meses antes función renal normal) y se le practica tratamiento de hemodiálisis con posterior diagnostico de nefropatía por oxalatos tras biopsia; tras 1 año sigue dependiente de diálisis y se la evalúa para trasplante de riñón.
En los casos 6, 7, 9 y 10 no se hace mención alguna a la dieta. En 6, 7 y 9 parece la deshidratación ser un potencial factor desencadenante; en 10 no se habla del estado de su celiaquía, que
podría dar lugar a mala absorción de grasas.
En el artículo de Lamarche
et alter* (2011) donde se expone el caso 8, también incluyen lista de casos de la cual se nutren Knight
et alter* (2017), pero incluyendo otro caso que estos se dejan atrás:
Realizando una búsqueda lo más exhaustiva que he podido, algún caso más he localizado en la literatura científica.
Buehner et alter* (2016) comentan dos casos de pacientes quemados finalmente fallecidos:
- Mujer
de 31 años con quemaduras en el 65% de su cuerpo y lesión pulmonar por
inhalación de humo, recibe 101g de vitamina C en 18 horas, muere a los
dos días del ingreso y la autopsia muestra, entre otras cosas,
nefropatía por oxalatos.
- Varón de 20 años con quemaduras en el
67% de su cuerpo, recibe 224g de vitamina C en 20 horas, muere a los
tres días del ingreso y la autopsia muestra, entre otras cosas,
nefropatía por oxalatos.
Resaltar que en estos casos, así como el quinto de Knight
et alter* (2017), la incidencia de insuficiencia renal como consecuencia de quemaduras extensas es alta, en torno al 30%, con mortalidad en torno al 80%, tal y como comentan
Clark et alter* (2017).
Otros, varios citados por
Lumlertgul et alter* (2018) y por Glew
et alter* (2014), el último par citan a Knight
et alter* (2017):
- Mujer de 57 años
ingresada por neumonía y daño renal agudo, tras 72 días y habiendo
recibido 30g de vitamina C intravenosa en ese tiempo, se le diagnostica
nefropatía por oxalatos tras biopsia; tras 6 meses desde su admisión
recupera parte de la función renal.
- Mujer de 75 años con ileostomía (con consiguiente riesgo de deshidratación) de hacía 2 meses y un sólo riñón desde hacía 14 años, tras recibir 240g de vitamina C intravenosa a lo largo de 18 días, ingresa en urgencias con fallo renal agudo e infección urinaria; la paciente permanece con tratamiento de diálisis.
- Mujer de 69 años con cirugía bariátrica previa, diabetes, enfermedad cardiaca congestiva, hipertensión y enfermedad renal en fase 3 estable por 15 años, y consumiendo 1g diario de vitamina C, acude a urgencias y es iniciada hemodiálisis al cuarto día y una biopsia posterior diagnostica nefropatía por oxalatos; la paciente murió en menos de un mes desde su alta de causa desconocida (no se realiza autopsia).
- Varón de 51 años diabético y tras 3 meses desde la cirugía bariátrica, con consumo de 1g diario de vitamina C, acude a urgencias por malestar por dos días con ingestión de líquidos y micción reducida; confirmada por biopsia nefropatía por oxalatos, recibió tratamiento sin hemodiálisis y recuperó función renal paulatinamente en 10 días.
- Mujer de 59 años que declina quimioterapia paliativa, tras 30 días con un consumo de 4g diarios de vitamina C, se le diagnostica fallo renal agudo con posterior confirmación de nefropatía por oxalatos con biopsia; tras tres semanas con tratamiento de diálisis no había recuperado función renal y fue trasladada a la unidad de cuidados paliativos.
- Mujer de 33 años con consumo de 2g diarios de vitamina C por más de diez años con insuficiencia renal de causa desconocida, tras 6 días desde el trasplante de riñón (sin historia previa de cálculos renales, sin ser determinada la concentración de oxalatos ni en sangre ni en orina previa al trasplante) sufre de fallo renal agudo, con posterior diagnóstico de nefropatía por oxalatos tras biopsia; tras tratamiento diario de diálisis no mejora su función renal y pasa a tratamiento crónico de diálisis.
- Varón de 23 años acude al hospital tras 3 días de malestar, con náuseas y tras 24 horas sin orinar; tras biopsia se diagnostica nefropatía por oxalatos y recibe tres sesiones de diálisis en la primera semana, con mejora de la función renal y recuperación posterior tras 4 meses. Sospecha de exceso de vitamina C en la dieta (0'42g diarios) o intoxicación por etilenglicol que ya desapareciera de su organismo (no detectado en análisis); no se comenta la abundancia o no de oxalatos en la dieta.
- Varón de 69 años con hiperplasia benigna de próstata y resección previa de parte del intestino grueso (¿potencial peligro de deshidratación?), con un consumo diario de 2g de vitamina C los dos últimos años, acude a urgencias tras tres semanas empeorando en cuanto a fatiga y falta de apetito; se le diagnostica fallo renal; al quinto día inician 4 sesiones de diálisis y se le practica biopsia resultando en diagnóstico de nefropatía por oxalatos; tras cambio de dieta a baja en oxalatos y suprimir el suplemento de vitamina C, recupera gran parte de la función renal a los 4 meses del alta.
- Varón de 59 años diabético con trasplante previo de riñón de hacía 11 años, ingiriendo una cantidad estimada el último mes de 2–3 g al día de vitamina C por su dieta alta en fruto de anacardo (no el fruto seco) y zumo de este, acude a análisis de control y se le diagnostica fallo renal, por lo que se le ingresa; la biopsia del riñón confirma diagnóstico de nefropatía por oxalatos; tras 5 tratamientos de diálisis recupera función renal y es dado de alta, siguiendo la mejora en el seguimiento 3 meses después.
¿Conclusión sobre el papel de la vitamina C en la nefropatía por oxalatos?: del estudio de la Clínica Mayo por Getting
et alter* se deduce que no suele estar implicada la vitamina C, y cuando lo está, vistos todos los casos publicados que he localizado, no parece ser sino factor secundario, con causa principal usualmente insuficiencia renal, mala absorción de grasas o deshidratación.
Mi conclusión tanto de los estudios sobre cálculos renales como de los casos localizados de nefropatía por oxalatos con vitamina C implicada, es que para evitar ambos teniendo tanto función renal como absorción intestinal normales y sin causa genética de producción endógena excesiva de ácido oxálico, debería bastar con llevar una dieta no muy alta en oxalatos, un consumo de calcio generoso (lácteos en mi caso) y garantizar una
buena hidratación.
Por otra parte un consumo
excesivo (con cierto sentido común, NO consumo de batidos verdes con ruibarbo, por ejemplo, sino pongamos panzada de chocolate negro) puntual de oxalatos no debería dar lugar a problemas dado que los cálculos renales no se forman de un día para otro y
de igual forma que pueden crecer también pueden menguar (vía
Ana Muñiz).
Medidas adicionales, de ser necesario, incluirían suplementación de magnesio (
reducción de absorción de ácido oxálico y prevención de formación de oxalato cálcico en orina), de vitamina B6 (
para reducir endogénesis) y de citrato de potasio (
para aumentar el citrato en orina y
capturar el calcio, vía
Miguel).
¿Cómo habían sido mi dieta y hábitos los últimos siete años antes del 2018?:
- Mi dieta era alta en verduras, siendo dos de las tres de consumo alto (mayoría de días a la semana) tanto las espinacas como las acelgas; la otra, las judías. Es más, casi siempre que cocía las verduras junto con mejillones y/o gambas, pues aprovechaba para beberme el agua de cocción... por eso de los minerales y vitaminas. El peligro de la ignorancia (y de Popeye).
- Mi consumo de vitamina C era de 3g diarios.
- Mi consumo de agua era según sed... que no digo que sea mala idea en general, pero que quizás no sea lo adecuado con consumo de suplementos de vitamina C, por ejemplo.
- Mi consumo de vitamina C en caso de enfermedad, como por ejemplo para combatir catarros/gripes/amigdalitis/otitis/conjuntivitis...
era del rango de decenas de gramos, y no siempre con ingesta generosa de agua, por no salir del despacho a por más, por ejemplo.
Además, previo a febrero del año pasado, había descendido mi consumo de torreznos (
mitad grasa, mitad proteínas, colágeno y elastina básicamente) en favor de cortezas de cerdo (
al menos dos tercios son proteínas), por cuestión de
control de existencias. También mi consumo de magnesio había decaído, esta vez más por despiste que otra cosa, pasando de la pastilla diaria de 200mg a una semanal o así, en contra de la estrategia que ya
había comentado en su día (consistente en confiar que
el magnesio redujese el riesgo de posible cálculo renal).
Pues bien, en febrero del año pasado, tras unos días tomando dosis más elevada de
la habitual por un principio de amigdalitis (supongo), tuve una piedra
en el riñón izquierdo.
En fin,
como en su día le comentaba a Mario por el blog de David Lozano:
«De las piedras en los riñones... no voy a ser yo quien ningunee la
experiencia personal: de ocurrirme a mí, o bien hubiese bajado o subido la dosis de vitamina C. Pero o sólo ocurre en personas predispuestas, o sólo en el sexo masculino, porque además de la experiencia clínica del Dr. Cathcart al respecto, también existe, al menos, un estudio donde no se encontro relación entre consumo de vitamina C y piedras en mujeres.»
Aunque adopté en parte la estrategia ahí expuesta, bajando dosis de vitamina C a 0'5–1g al día (sigue siendo dosis efectiva para esquivar el acné
juvenil en mi caso), estoy tomando alguna otra medida mucho más importante:
- bebo fuera de comidas más que antes, sin llegar a sensación de náusea, claro;
- he vuelto a los torreznos;
- intento no despistarme con el malato de magnesio... con éxito moderado, que como es el suplemento que tomo a la cena (el resto van en el desayuno) me sigo despistando;
- procuro sacrificarme y comer queso con alimentos altos en oxalatos, como por ejemplo el chocolate negro; y, la principal,
- como con menos frecuencia acelgas y espinacas, y cuando lo hago las escurro TODO lo que puedo.
Pues bien, la estrategia por el momento
parece efectiva para evitar cálculos renales (ya, tiempo muy corto), pues en lo
que va desde entonces ya he saturado en vitamina C tres veces, la
primera para un catarro (cantidad contenida, hasta notar ese picorcillo
favorable en la nariz al tiempo de la desaparición de síntomas), las
otras dos ya más generoso hasta síntoma de saturación habitual. Eso sí,
me he pasado a vitamina C en polvo, tanto ácido ascórbico como ascorbato
sódico, y ya sólo tomo en pastillas (cápsulas, que relleno yo, de unos
0'8g o así) por conveniencia si tengo que tomarla en el despacho, y en cualquier caso esos días procuro especialmente beber agua en cantidades generosas.
Quien prefiera prescindir de la suplementación de vitamina C, incluyendo sobre todo cuando esté enfermo de catarros, gripes, etc., pues... ¡buena suerte!, sigo pensando que la necesitará más que yo.
*
[Añadido el 7/XI/2023] Esquivaba la abreviatura
et al. porque tengo personal aversión por abreviaturas y siglas. Pues bien, tal y como
me ha corregido Athaic la forma completa no es
et alter* sino que dependerá del sexo de los autores:
et alii como masculino (¿genérico?),
et aliae como femenino, o
et alia como neutro... Me rindo: empezaré a abreviar, salvo que alguien con mucho mejor nivel de latín que yo (no va a ser difícil) me confirme que
et alia sería correcta en cualquier caso.